- 近期网站停站换新具体说明
- 按以上说明时间,延期一周至网站时间26-27左右。具体实施前两天会在此提前通知具体实施时间
主题:甘露糖作用及购买渠道 -- 陈王奋起
2018年以来,科学界最大的亮点可能就是阿尔茨海默病(AD)的感染致病理论了。
去年6月,奇点曾报道科学家发现疱疹病毒可能才是AD的致病因素;前不久,又报道了会引起口腔溃疡的白色念珠菌可以引起疑似AD的病征。
2019年1月,加州大学旧金山分校的Stephen Dominy博士领导的团队发现,引起牙周炎的细菌——牙龈卟啉菌,同样会导致AD。这些研究都指向同一个方向——病原体感染,可能才是导致AD的真正元凶!
在这个研究中,Stephen团队先是在AD患者的大脑中检测到了牙龈卟啉菌的存在,又通过小鼠实验证实牙龈卟啉菌进入大脑后释放的一种分泌蛋白才是导致AD的关键。随后,他们在人体中还发现抑制该蛋白能够起到治疗AD的作用。此外,该团队还证实,β-淀粉样蛋白具有抗细菌感染的作用。
这个研究可能指导我们透过表象(tau蛋白和β-淀粉样蛋白沉积等),找到AD真正的病因,进而找到治疗AD的办法。相关论文发表在著名学术期刊Science Advance上[1]。
这些年来,学界对AD研究的重点一直是tau蛋白和β-淀粉样蛋白沉积等,但是针对这些蛋白的药物的临床试验却几度碰壁。这也让相关领域一直被悲观的情绪所笼罩。不过,也一直有科学家在迷茫旷野中寻找新的出路。
除了tau蛋白和β-淀粉样蛋白沉积这些典型的特征外,AD病人还会表现出神经炎症,这和病原体感染的症状很像[2]。所以,也有人怀疑感染才是AD的病因,但却找不到切实可靠的证据。
Stephen Dominy博士在上世纪90年代时,曾在加州大学旧金山分校治疗HIV携带者。当时,他发现一些因HIV导致认知障碍的患者,在接受抗病毒药物治疗后,认知能力恢复了。这让他对AD感染理论产生了强烈的兴趣[3]。
早有证据表明,牙齿脱落、牙周疾病和AD有很深的联系。而牙龈卟啉菌也被认为是β-淀粉样蛋白沉积、痴呆、AD的高危风险因素。一项前瞻性观察研究显示,相比对照组,有慢性牙周炎的患者在6个月内认知能力有明显下降[4-9]。
并且,科学家还发现牙龈卟啉菌可以在冠状动脉、胎盘及肝脏中定植[1]。而牙龈卟啉菌在人体内横行无忌的原因之一,就是它能分泌一种牙龈蛋白酶。这个牙龈蛋白酶具有帮助细菌定植,压制宿主免疫系统,以及破坏组织等多种作用,并对很多细胞具有毒性[10]
鉴于牙龈卟啉菌与AD有如此紧密的联系,Stephen博士和合作者开办了一家公司,研究对AD的治疗。他将目标锁定在牙龈卟啉菌身上,并在AD死者大脑中寻找牙龈卟啉菌[3]。
研究人员先是检测了AD死者的大脑样本,发现所有的样本中都有牙龈卟啉菌。随后,他们又检测了具有轻度至中度认知障碍的疑似AD患者的脑脊液,同样也发现大部分患者的大脑中都有牙龈卟啉菌感染。这说明牙龈卟啉菌确实能进入大脑,并在大脑中定植。
前面我们提到过,牙龈蛋白酶是牙龈卟啉菌的毒性因子。科学家猜测,如果牙龈卟啉菌是AD的病因的话,那么其分泌牙龈蛋白酶可能会损伤神经。
实验结果证明确实如此。研究人员一共检测了50份AD死者的大脑样本,发现在超过90%的样本中都有牙龈蛋白酶的存在。这个蛋白遍及神经元、星形胶质细胞、受损的海马体以及大脑皮层,并且还发现其与tau蛋白和β-淀粉样蛋白沉积的位置重叠。
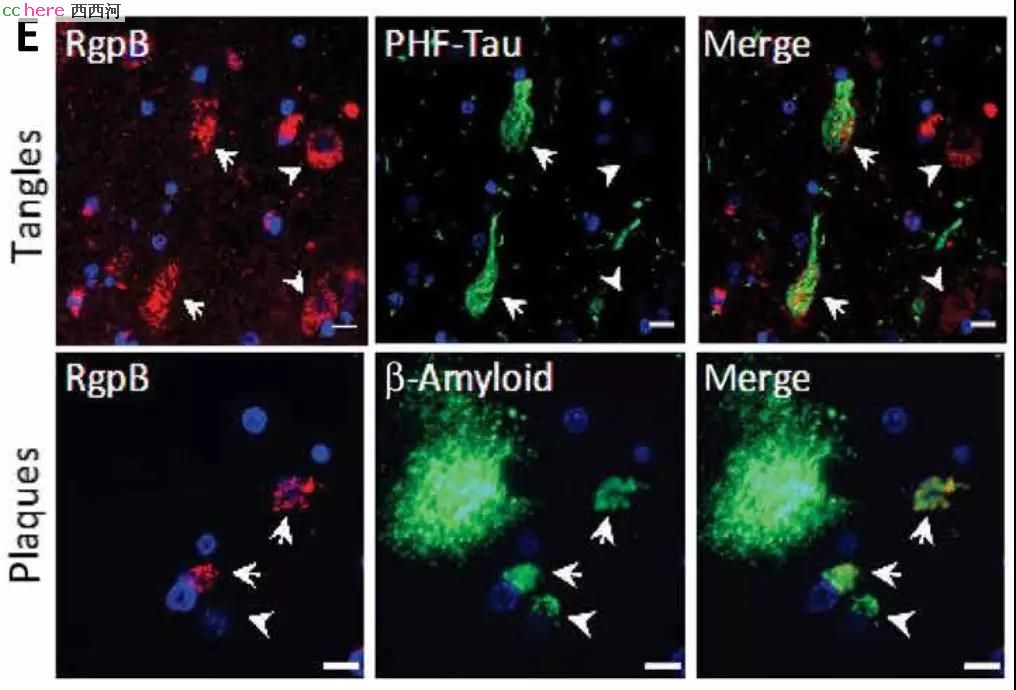
随后,研究者在体外证明牙龈蛋白酶具有将tau蛋白切成碎片的功能。这说明,AD患者大脑中出现的tau蛋白缠结很可能就是牙龈蛋白酶引起的!牙龈卟啉菌引起AD的嫌疑极大。
那牙龈卟啉菌到底会不会引起AD呢?
研究人员通过动物实验进行了验证。他们让小鼠口腔感染牙龈卟啉菌,发现6周后,所有小鼠的大脑中都感染了牙龈卟啉菌,并且引发了β-淀粉样蛋白沉积。有意思的是,他们发现这些β-淀粉样蛋白具有抑制牙龈卟啉菌的作用,印证了之前β-淀粉样蛋白是抗菌斗士的研究。
前面提到过,牙龈蛋白酶可能是造成神经损伤的关键因素,若牙龈卟啉菌不能表达这个蛋白会怎样呢?研究人员将牙龈卟啉菌的牙龈蛋白酶编码基因敲除,然后用突变菌感染小鼠口腔,发现小鼠大脑内的病原菌明显降低,而β-淀粉样蛋白沉积也大幅减少。这说明牙龈蛋白酶对于牙龈卟啉菌引起AD是至关重要的。
而这还说明一个问题,那就是可以通过抑制牙龈蛋白酶来治疗AD!(广谱抗生素无法根除牙龈卟啉菌,且可能导致抗性)
Stephen团队找到了一种专门抑制牙龈蛋白酶的小分子抑制剂。将这个抑制剂给被感染的小鼠口服后,确实能起到保护小鼠大脑神经元,抑制细菌生长以及降低β-淀粉样蛋白沉积的作用。
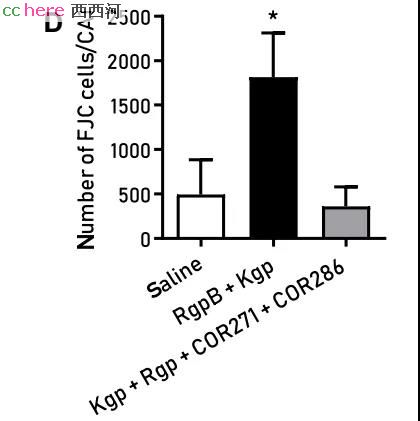
这是继疱疹病毒后,又一种病原体被明确证实会引发AD。同时,研究者们又一次验证了β-淀粉样蛋白的抗感染功能。越来越多地证据表明,AD可能是病原体感染引发的,而之前人们所关注的蛋白沉积可能仅仅是感染的结果。这或许能指导我们破除迷雾,找到AD的源头,彻底解决这个威胁着数千万人健康的疾病。
牙龈卟啉菌可能不是导致AD的唯一原因,但从研究者们提供的数据来看,可能也占据了相当的比例。因而,这个研究对于治疗AD有重要意义。
研究中所用到的小分子抑制剂COR388,在初步的临床研究中,有9名AD患者的认知得到改善。研究者表示,他们对这个结果感到鼓舞,后面将会组织临床Ⅱ/Ⅲ期试验[11]。
COR388的最新进展:
As of June 2019, two Phase 1 trials of COR388 have been completed. In a single-dose study of 5 to 250 mg capsules in 34 healthy adults, the compound was safe and well-tolerated. A multiple-dose study assessed safety and tolerability in 24 healthy older adults (mean age of 60 years) and nine with AD (mean age 72). According to a company press release, healthy adults received 25, 50, or 100 mg COR388 or placebo every 12 hours for 10 days; AD patients took 50 mg or placebo every 12 hours for 28 days. The pharmacokinetic profile of COR388 in AD and controls was reported to be similar. All volunteers with AD had P. gingivalis DNA fragments in their CSF at baseline. COR388 caused no serious adverse reactions, no one withdrew.
A Phase 2/3 trial (GAIN) evaluating a 48-week course of COR388 in 573 people with mild to moderate AD began in April 2019. Participants take either 40 mg, 80 mg, or placebo. The primary endpoint will be ADAS-Cog11 score; further outcomes include ADCS-ADL, CDR-SB, MMSE, NPI, the Winterlight Speech Assessment, MRI brain scans, and P. gingivalis DNA measurement in CSF before and after treatment. This trial involves 32 sites in the U.S.; topline data are expected in late 2021.
来源:
https://www.alzforum.org/therapeutics/cor388
参考资料:
[1] Stephen S. Dominy et al. Porphyromonas gingivalis in Alzheimer’s disease brains: Evidence for disease causation and treatment with small-molecule inhibitors. 2019; 5 : eaau3333 DOI: 10.1126/sciadv.aau3333
[2] T. Wyss-Coray, J. Rogers, Inflammation in Alzheimer disease—A brief review of the basic science and clinical literature. Cold Spring Harb. Perspect. (2012) Med. 2, a006346
[3]https://www.sciencemag.org/news/2019/01/gum-disease-causing-bacteria-could-spur-alzheimer-s
[4]E. K. Kaye, A. Valencia, N. Baba, A. Spiro III, T. Dietrich, R. I. Garcia, Tooth loss and periodontal disease predict poor cognitive function in older men. J. Am. Geriatr. Soc. 58,713–718 (2010).
[5] M. Gatz, J. A. Mortimer, L. Fratiglioni, B. Johansson, S. Berg, C. A. Reynolds, N. L. Pedersen, Potentially modifiable risk factors for dementia in identical twins. Alzheimers Dement. 2, 110–117 (2006).
[6] P. S. Stein, M. Desrosiers, S. J. Donegan, J. F. Yepes, R. J. Kryscio, Tooth loss, dementia and neuropathology in the Nun study. J. Am. Dent. Assoc. 138, 1314–1322; quiz 1381–2 (2007).
[7] A. R. Kamer, E. Pirraglia, W. Tsui, H. Rusinek, S. Vallabhajosula, L. Mosconi, L. Yi, P. McHugh, R. G. Craig, S. Svetcov, R. Linker, C. Shi, L. Glodzik, S. Williams, P. Corby, D. Saxena, M. J. de Leon, Periodontal disease associates with higher brain amyloid load in normal elderly. Neurobiol. Aging 36, 627–633 (2015).
[8] J. M. Noble, L. N. Borrell, P. N. Papapanou, M. S. V. Elkind, N. Scarmeas, C. B. Wright, Periodontitis is associated with cognitive impairment among older adults: Analysis of NHANES-III. J. Neurol. Neurosurg. Psychiatry 80, 1206–1211 (2009).
[9] M. Ide, M. Harris, A. Stevens, R. Sussams, V. Hopkins, D. Culliford, J. Fuller, P. Ibbett, R. Raybould, R. Thomas, U. Puenter, J. Teeling, V. H. Perry, C. Holmes, Periodontitis and cognitive decline in Alzheimer’s disease. PLOS ONE 11, e0151081 (2016).
[10] M. J. Gui, S. G. Dashper, N. Slakeski, Y.-Y. Chen, E. C. Reynolds, Spheres of influence: Porphyromonas gingivalis outer membrane vesicles. Mol. Oral Microbiol. 31, 365–378 (2016).
[11]https://debuglies.com/2019/01/24/porphyromonas-gingivalis-bacterial-pathogen-may-contribute-to-alzheimers-disease/
- 相关回复 上下关系8
压缩 3 层
🙂对生命和自然多点敬畏,不要轻易下结论 4 陈王奋起 字280 2019-07-31 02:41:46
🙂待认可未通过。偏要看
🙂AD 4 neuron 字519 2019-07-24 01:52:11
🙂加州大学旧金山分校的Stephen Dominy的最新
🙂对照 2 neuron 字109 2019-07-27 00:59:26
🙂正常人的大脑感染细菌或者病毒会引发严重的脑膜炎 5 陈王奋起 字474 2019-07-29 00:42:15
🙂不刷牙导致老年痴呆? 2 孟词宗 字111 2019-07-24 09:13:58
🙂为什么有待认可出现? 陈王奋起 字0 2019-07-25 01:42:19