主题:【原创】死亡起源 The Origin of Death -- az09
续上,死亡起源(十一)
比线虫更复杂的,是哺乳动物在饥饿压力下的反应。其实饥饿可以导致寿命延长本就是在作为哺乳动物的老鼠的身上首先被观察到的。
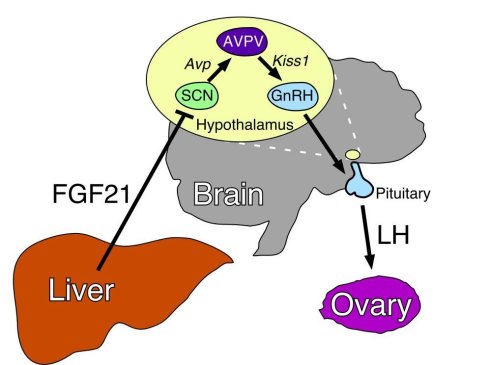
2012年10月得克萨斯大学西南医疗中心(UT Southwestern Medical Center)的研究者们《eLife》杂志上发表题为《饥饿激素,成纤维细胞生长因子21(FGF-21),延长小鼠寿命》[23]的研究论文。ScienceDaily 为此还专门配发了一篇评论:《饥饿激素显著延长小鼠寿命而无需限食》 [24] 。关于Fibroblast Growth Factor-21(FGF-21)的研究是最近比较热门的一项研究,因为它和许多有趣的生命控制机制都相关。FGF-21是一种所谓的“饥饿激素”,它主要由肝脏分泌,在空腹时,肝脏会分泌这种激素以此让身体做出适应饥饿的反应,它是一种行为很像激素的生长因子。人体的其他部位包括下丘脑也会分泌这种物质。得克萨斯大学的研究者们冒着失败的风险,做了一个很昂贵的实验。他们花了几年的时间,培养了一些可以过分表达和分泌FGF-21的转基因小鼠,并观察他们的寿命。他们并没有对这些小鼠限制食物,而是提供了足够的食物,不过观察的结果是,这些FGF-21长期过量分泌的小鼠的平均寿命要比普通小鼠增加30%,特别是对于雌鼠来说,其寿命要增加40%之多!研究者对此很兴奋,该文章的共同作者、他们的药理学主席David Mangelsdorf博士说:“长期过量生成FGF21激素使得小鼠无需减少食物摄取即可获得极长的寿命。它在没有节食的情况下模拟并获得了需要通过节食才能获得的健康与益处。”
不过这次我的视点还是没有集中到小鼠的寿命的延长上,因为这我看来,这本就天经地义。我视点在FGF-21的副作用上。因为包括该文的研究者也承认,FGF-21过量分泌的小鼠要比普通的野生小鼠体型更瘦小,并且伴有严重的骨质疏松。另外,最关键的一点是,FGF-21会导致雌鼠不育! 我们只要比较一下前面提到的线虫为什么延长了寿命,再和这个例子里面小鼠做一个对比,就可以观察到一个共同点——它们都抑制了生殖系统。
2013年8月,《Nature》的子刊《Nature Medicine》刊登了一篇文章“《FGF-21有助于神经内分泌控制雌性的生殖》(FGF21 contributes to neuroendocrine control of female reproduction)[25],描述了过量分泌的FGF-21是如何抑制雌性小鼠的生殖系统的。文章指出,FGF-21可以抑制雌性小鼠的生殖系统,导致性腺机能减退,以及雌激素等激素的降低。而且有趣的是,FGF-21在导致雌鼠不育的同时,却也使得雌鼠获得超过雄鼠的寿命的延长。雌鼠获得的寿命的延长要比平均寿命延长高10%,达到惊人的40%。
另外,除了导致雌鼠不育以外,“饥饿激素”FGF-21会导致食物和营养并不短缺的小鼠出现严重的骨质疏松也很有趣。其实生命本就有许多类似的抑制机制。比如,当我们遇到危险逃命的时候,我们的交感神经会变得十分兴奋,而副交感神经则受到压抑,表现出来的就是与逃命相关的项目获得增强,比如心跳加快,肾上腺素大量分泌,而与迫在眉睫的危险无关的,比如生殖、胃的消化、唾液的分泌等等,都会受到抑制,体内对这些部分提供的血液也会随之减少。这本就是生物的一个非常正常的应急反应——把能量用在最需要的地方。关于骨质疏松症,我解释一下:我们体内的钙循环是和骨骼相关的,我们的骨骼即便是在成年以后也是非常活跃的,一直在经历着生长和破坏的过程,也在不停的在与身体进行钙离子的循环和交换。钙离子对于身体来说极为重要,它是机体各项生理活动不可缺少的离子。 它对于维持细胞膜两侧的生物电位,维持正常的神经传导功能,维持正常的肌肉伸缩与舒张功能以及神经——肌肉传导功能都至关重要。而我们的骨骼,正是我们身体钙离子的储藏库。正常情况下,骨骼和其他器官之间的钙离子的循环会处于一个平衡的状态。不过随着年龄的增大,在某种机制的作用下(表现之一是老年人对钙的吸收率快速下降),钙离子的循环会变得不平衡,所以常常说老年人要补钙。另外,怀孕期的妇女因为母体需要将大量的钙提供给胎儿建造身体和骨骼,也会导致母体临时性的缺钙和骨质疏松——也就是说,母体把自己库存的钙大量提供给了胎儿,导致了自己体内的钙储备的库存空虚。而“饥饿激素”FGF-21所表现出来的对生殖系统和钙离子循环的抑制,似乎和我们在危险情况下逃命时机体做出的反应类似,是一种身体在食物缺乏(或者是以为自己处于食物缺乏状态)条件下的一种适应性反应。因为我们的机体许多的通讯是靠激素传递的,所以过量分泌的“饥饿激素”FGF-21可能让我们的身体(应该也是下丘脑)以为我们处于一个食物缺乏的状态,所以,它可能通过某种机制,减缓了对骨骼对钙的吸收,以保证更加重要的器官和组织不会因缺钙而失去功能,而与此同时,骨骼中的钙库存可能还在正常释放与流失,所以最终表现出来的就是实验小鼠严重的骨质疏松。所以这些小鼠的骨质疏松和孕期妇女的骨质疏松的原因是很相似的。尽管得克萨斯大学的研究者对FGF-21所表现出来的延长小鼠寿命很兴奋,但是,我对FGF-21是否真的可以让我们健康的长寿表示怀疑,我相信应该有更加深刻而且独立的机制在作用,FGF-21只是触发了这套机制的一部分而已。
同样可以对生殖系统产生抑制,并且与肝脏分泌的“饥饿激素” FGF-21类似的,是肠胃也可以分泌“饥饿激素”。Ghrelin 就是一种由主要由肠胃分泌的“饥饿激素”,胃肠,主要是胃,在空腹状态下会产生大量的这种激素。2013 年10月,伦敦帝国学院医学研究所的Alexander N. Comninos团队在《牛津期刊》旗下的human reproduction update发表了一篇文章《肠道与脂肪分泌的激素与生殖的关系》 [26],描述了生殖系统与上述两种激素的关系和作用机制。如图所示,肠胃分泌的“饥饿激素”Ghrelin 信号在雌性和雄性内分泌系统的生殖轴上,对生殖系统也是有强抑制作用的。
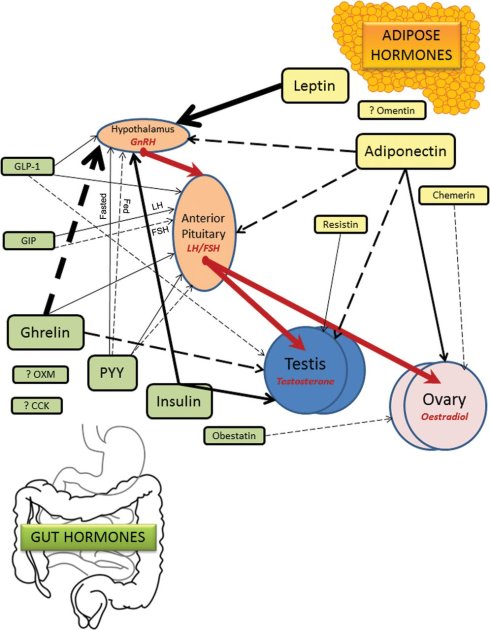
图51. 肠道分泌的激素和脂肪分泌的激素与生殖之间的关系。图中的实线代表促进作用;虚线代表抑制作用;粗线表示作用强。图中我们可以看出,肠胃的“饥饿激素”Ghrelin信号会通过下丘脑(hypothalamus)——脑垂体(Anterior Pituitary)——生殖系统睾丸(Testis)和卵巢(Ovary),对雄性和雌性的生殖系统造成强抑制。
与肝脏分泌的FGF-21类似的,肠胃产生的Ghrelin如果过量分泌的话,也可能导致骨质疏松。多数临床研究支持Ghrelin与骨量、骨密度正相关,也就是会促进骨骼生长。但是在神经性厌食症患者身上观察到的Ghrelin反常升高可引起生长激素抵抗和促肾上腺皮质激素升高,进而导致全身性骨流失以及青少年峰值骨量获得性缺失[27]。也就是说,过量分泌的Ghrelin和过量分泌的FGF-21一样,都会导致骨质疏松。
至于过量分泌的饥饿激素Ghrelin 是否能够如另一种饥饿激素FGF-21一样,也可以导致小鼠的寿命的极大延长,我没有看见相关的实验报道。相信主要还是因为这是一个需要耗时超过3年甚至4年的昂贵实验。FGF-21对小鼠的寿命延长实验是在2007年开始,2012年才出来结果。不过,在2007年左右,就已经有人开始相信Ghrelin可能可以延长寿命了。2008年11月《Life Enhancement Magazine》杂志发表了一篇文章《Ghrelin: A Mere Hormonal Appetite Stimulant or a Possible Anti-Aging Molecule》,(Ghrelin: 一个纯粹的荷尔蒙食欲兴奋剂,或者是一个可能的抗衰老分子),文中提到有证据表明,衰老可能和Ghrelin的分泌减少或者Ghrelin受到阻碍相关[28][29]。
既然空腹时产生的某些饥饿激素可以让我们长寿,那么,如果吃饱了饭后分泌的某些激素的分泌不足,会不会也让我们长寿呢?答案是肯定的。和上述两种在空腹时大量分泌的“饥饿激素”相反,我们吃饱了饭也是会大量分泌许多激素的。主要由肝脏分泌的IGF-1生长因子 (insulin-like growth factors-1)便是其中一种。IGF-1可以被译作“类胰岛素生长因子-1”,因为它的结构和功能都和胰岛素很相似,它是人体内肝细胞、肾细胞、脾细胞等十几种细胞自分泌和旁分泌的产物(也就是说人体内细胞本身就含有IGF-1)。早在1993年,加州大学的著名分子生物学家Cynthia Kenyon第一个发现了如果线虫体内IGF-1分泌不足,或者胰岛素/IGF-1受体因为基因变异而削弱(也就是线虫的daf-2基因出现突变),会使得线虫的寿命延长为普通线虫的两倍,这是非常显著的寿命的延长。这项研究也从此开启了通过寻找线虫的基因突变研究衰老机制之门。进一步的研究发现,如果胰岛素/IGF-1受体基因变异,使得受体功能削弱,那么我们可以在包括苍蝇、小鼠、甚至人类身上都观察到寿命的延长[30]。一项对世界各地的90-100岁老人的调查发现,许多人身上都发现了这个基因突变从而导致了这个受体都受到削弱。所以,体内低水平 的IGF-1或者胰岛素/IGF-1 受体受到削弱,是一个已经被大量证据证实的,可以延长寿命的因素。
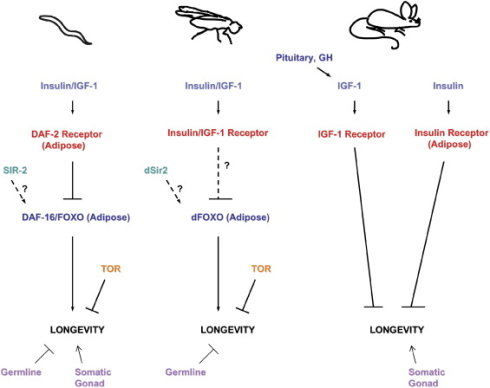
图52. 与IGF-1相关的基因和信号通道被证明影响到多种生物的寿命。图片来自: http://dx.doi.org/10.1016/j.cell.2005.02.002
其实IGF-1的分泌不足或者受体削弱,简单来说,所代表的含义,是和饥饿激素过量分泌是一样的。都意味着食物短缺(或者让机体以为自己处于食物短缺,当然,实际情况可能要更复杂)。而且有趣的是,在哺乳动物身上观察到,低水平的IGF-1和“饥饿激素”过量分泌一样,在延长寿命的同时,都会导致小鼠生殖发育的迟缓[31] [32],以及骨质疏松[33]。不过比饥饿激素会导致雌鼠不育好一些的是,它们的生殖系统最终还是会发育的,并不会因此不育。这其实很好理解:IGF-1水平低下代表的可能是糖和脂类等等的摄入不足,这和“饥饿激素”代表的肚子空空,完全没有食物显然轻微许多。所以,饥饿激素过量分泌会导致不育,而IGF-1水平低下只是延缓生殖,毕竟,对于生命来说,生殖才是第一要务。
有趣的是,线虫的IGF-1因素所致的寿命延长,似乎没有以牺牲健康为代价。一开始大家以为IGF-1虽然可以延长寿命,但是,它将是不健康的,比如细胞内线粒体的老化它就无法避免,所以它的老年必定行动迟缓,晚景凄凉。但最新的一则研究则颠覆了这种假设。2015年11月20日发表于《Nature Communications》的一篇文章[34],揭示了IGF-1受体受到削弱的线虫不但能够长寿,而且也更健康。这篇文章的意义在于找到了一种可以有效描述线虫活性和健康状态的方法,并对比了IGF-1受体基因突变的线虫与普通野生线虫的健康状态。他们的研究结论是,IGF-1受体基因突变(也就是线虫的daf-2基因出现突变)的线虫,更健康,更有活力,并且表明它们的细胞的线粒体也更健康。这项研究实际上揭示了线虫的生命中内含的,可以健康的延长寿命的潜力。
说一个题外话,即便是如Cynthia Kenyon 这样的大牛,也有一个我认为是错误的观点:她认为线虫获得寿命延长主要是基因突变所致,所以她曾经提出一个问题: 从线虫到人类,寿命提高了几千倍,假设线虫是我们的祖先,那么需要积累多少个基因突变才能达到这样的效果呢?我认为她这样的想法是错误的,她还没有意识到线虫们的长寿,是来自于生命内含的那种“永生”的能力,线虫要做的,只是抑制这种能力,并在必要的时候对寿命这个变量进行调整。而且大量的证据也证明了这一点:(1)饥饿所致的线虫寿命延长就不涉及到任何的基因突变,它们也可以获得如daf-2基因突变的线虫一样的两倍的寿命;有研究表明,线虫由饥饿获得的长寿特点,也可以通过Small RNA诱导的基因静默获得,并以表观遗传的方式遗传,并且可以遗传几代[35]。Daf-2基因突变所触发的长寿,其实是个“作弊”的结果,它靠削弱胰岛素/IGF-1受体的功能获得,它其实并不是一个多么稳定的结构,这可以从大部分线虫并不拥有这个基因突变可以看出,这种突变不具有演化优势。不过这个基因突变的意义在于告诉我们:我们可以通过“作弊”的方式骗过我们的死亡机制。(2)线虫的生殖细胞也是永生的,它也无需任何基因突变;(3)线虫的近亲,多次繁殖的美洲钩虫就有超过15年的寿命,线虫的祖先,水螅则可能接近永生。它们都无需演化到人这么高级,就已经可以获得和人类一样,甚至远超我们寿命的长寿了。
可以延长线虫寿命的方法其实还有许多,比如前面已经提到,直接抑制线虫的生殖系统,它们的寿命也可以获得延长。典型的例子是具有glp-1(e2141)基因突变的线虫没有生殖细胞系,它们的寿命也可以获得延长[36]。另外,美国托马斯杰斐逊大学(Thomas Jefferson University)生物化学与分子生物学系的研究人员发现线虫中单一蛋白质的水平就可以决定线虫的寿命。线虫出生时如果没有这种被称为抑制蛋白(arrestin)的蛋白质,那么它的寿命要比正常情况大约长三分之一;如果体内有三倍这种抑制蛋白的线虫,它的寿命则会缩短三分之一。[37] [38]
为什么过量分泌的FGF-21、Ghrelin等“饥饿激素”或者IGF-1水平低下,在长期作用下,抑制了生殖系统的同时,会延长寿命呢?从演化的角度上说,生殖系统被抑制的原因只是和我们在逃命时抑制生殖系统类似,主要为了缓解食物短缺的燃眉之急,以保证机体的最低正常运转。不过,生殖毕竟还是生命的最终使命之一,不完成这个使命,它的生命就没有意义。所以,它必须要调整自己的寿命和死亡机制的触发时间,同时抑制需要消耗大量能量的器官,尽可能的延长寿命,熬到食物重新丰富的那一天,以完成生殖的任务。这是生命对食物短缺这种常见问题的一个适应机制。另外,对于人类来说,饥饿与寿命的关系,可能更加复杂。我们一方面可以观察到食物的丰富,可能会导致少年儿童的性早熟;另一方面,压力的降低却又可能延长寿命。而且每一个人生活经历都是不一样的,在众多复杂因素的共同作用下,具体到某一个个体,会有什么效果,其实还很难说。所以,现在的研究发现,通过饥饿的方法,似乎并不会让人类的寿命增加多少。
小结:从上述的压力导致寿命的减少,和饥饿对寿命的延长,以及各种基因突变,或者各种激素对寿命的影响,为我们揭示了几个重要的事实:
(1)动物拥有某种潜力使其较之正常状态存活得更长久——这个事实已经受到了广泛的承认。同时也揭示了寿命长短是可调的
(2)这些寿命的延长或缩短,或多或少,都与生殖相关。
(3)有许多不相关而且相对独立的因素,都可以导致寿命的延长。这暗示,真正控制寿命长短的机制,虽然和这些因素都有关系,却是一个和它们完全独立的机制,上面提到的这些导致寿命延长或者缩短的因素,只是恰好触发了这个独立的寿命控制机制而已。
3.2.4 关于表观遗传和压力的一些争议。
关于表观遗传和压力的关系还是存在一些争议的。毕竟,表观遗传还未被证明在任何外界压力下都会产生性状改变,它不能够像DNA遗传那样稳定可靠,另外,一些缺失的环节仍然有待发现。例如有实验表明,表观遗传的印记在没有环境压力的数代之后,可能会渐渐丢失。
当许多人在诟病并强调表观遗传的不稳定和不可持续性时,有没有想过,其实很可能,不稳定或许才是表观遗传所要强调的功能和特点啊。
很可能表观遗传的目的之一就是生物在演化过程中,它需要一个可以调节的临时变量,以此适应短期的环境变化。首先在生物生活的时候,遇到压力后,它可以马上就在自己的体内改变一些相关的甲基化水平等等,以此适应一些突然的环境变化;如果变化消失,这些甲基化也可能消失并且不将其遗传。如果这个压力强度大且持续,就有选择的将它遗传(注:是否选择遗传应该还有其他的一些机制,或许会有根据历史经验选择出来的优先级等等,因为有证据表明,基因本身或许可以决定自身是否产生甲基化,也就是说,基因自身可以控制自己的表观遗传 [39])。通常生物在后天获得的表观遗传并不持久,这其实很好理解。因为假设表观遗传一旦获得,就会长期遗传,那么当环境又变回去了,它又怎么重新适应呢?所以,当环境再次变化,压力减轻后,表观遗传即便不是完全逐渐清除,也是应该被清除一部分的。简单的说,如果环境压力消失,该物种干嘛还要着急的承担巨大的机会成本,并消耗巨大能量,去缩短寿命,甚至自杀呢?毕竟,自杀和重启系统是要消耗包括机会成本在内的巨大成本的,况且周围环境是否能够提供足够它们这样折腾的食物与能量也是一个问题。 当压力消失时,也就是环境再次变化时,将已经不适应环境变化的表观遗传的印记逐渐抹去,也是适应自然选择的。
3.2.5 关于压力、生殖、遗传三者之间对寿命的影响的一个小结
关于压力、生殖、遗传三者之间对寿命的影响,我认为一个合理的演化论的解释是: 如果动物遭遇到短期的压力,它需要启动一个应急机制,让自己变得更强壮,更具有竞争力。但是,如果这样做没有效果,它继续遭遇到持续的强大压力,这就意味着他可能遇到一个非常强大的生存威胁,这或者是环境,或者是天敌等等造成的。关于压力传递途径,除了它们自己的生活经历以外,我相信有相当部分是由信息素传播的。当它们同类遭遇到危险甚至死亡的时候,释放出来的信息素可以传遍整个区域,压力也因此传播开来,虽然这种压力我们人类完全感受不到,但是对于它们的同类来说,却是一种有形有质的压力,并且压力的强度和信息素的浓度相关,也就是我们通常所谓的,一种死亡的气息。压力之下,它就可能需要适当的提高敏感度,同时加快生长发育和死亡速度,缩短寿命,加快世代交替。因为如果不加快世代交替,它很可能在没有生殖之前,也就是没有传宗接代之前,就已经被天敌或者环境消灭。这样发展下去,它的整个种群都有被灭绝的危险。所以,它加快世代交替,提前死亡是可以获利的,这样的个体也会被自然选择所选择出来。在生物面临压力的同时,在它还活着的时候,就通过DNA甲基化等等表观遗传反应,对自己进行适应性改变,以此同时,在世代交替的时候,将这些改变有选择的遗传给后代,这样,它后天采集到的信息就在后代身上完成了一个对变化了的环境的信号反馈循环。至于世代交替速度到底应该多快,自然选择会告诉它。世代交替过慢,可能会在生殖之前就被消灭,它不会有后代;但是,世代交替过快,也可能因为能量消耗过大,同时也因为机会成本的丧失,或者是食物的缺乏,而导致来不及世代交替而被淘汰。不过,好在演化是以个体为单位进行的,那些世代交替速度刚好落在速度最恰当的区间的个体,会被自然选择选择出来。
至于对饥饿压力的适应,则相反,它需要延长寿命并抑制包括生殖在内的许多机能以应对食物短缺。因为生殖本身以及生殖后的后代的生长发育都是高耗能的生理活动,在食物短缺时期,抑制生殖能力,以避免母体和后代因食物短缺而死亡,是对饥饿所造成的压力的一个正确的反应,这样的个体会被自然选择所选择出来。与此同时,表观遗传也要介入,饥饿所造成的压力,在造成母体长寿的同时,也是可以遗传的,这导致了后代的长寿,当然,这是一个临时变量,是可以修改的,所以,表观遗传通常只有几代的效果。2014年7月,美国哥伦比亚大学发表于《Cell》期刊的一项研究表明,线虫的饥饿经历,在延长自己寿命的同时,也是可以通过Small RNA诱导的表观遗传遗传给后代的,使得后代的寿命获得延长,而且这种遗传可以延续好几代。[35]
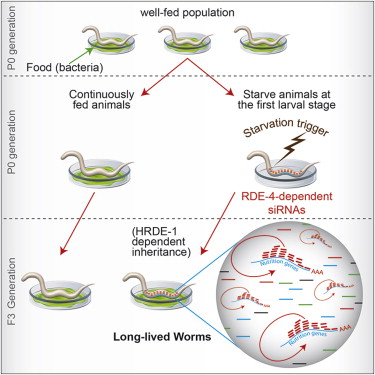
所以,结果就是,压力、生殖、遗传(包括表观遗传)通过相互作用和相互合作,获得了一个完美的对外界变化环境的反馈循环。
当然,这所有的一切,都有一个前提,那就是,寿命长短是双向可调的,这是由生命所内含的“永生”属性所决定的。而且生物拥有一个独立的调整自己寿命的机制,它可能和许多因素都有联系,不过这套机制本身是相对独立的。上面的大量讨论和证据,其实都已经指向了这一点。并且,相信生物的寿命绝不是某个单个因素或者单个基因控制的,现在的大部分研究,可能都只是如管中窥豹一般,只看见了豹子身上的一两片斑纹,而内在的更加深刻的全局机制,也就是那一整头豹子,尚隐藏在迷雾当中..........
待续...........请点击:死亡起源(十三)
备注与参考文献
[23] Yuan Zhang,1 Yang Xie,2 Eric D Berglund,3 Katie Colbert Coate,4 Tian Teng He,5 Takeshi Katafuchi,1 Guanghua Xiao,2 Matthew J Potthoff,4 Wei Wei,1 Yihong Wan,1 Ruth T Yu,6 Ronald M Evans,6 Steven A Kliewer,7,* and David J Mangelsdorf4, The starvation hormone, fibroblast growth factor-21, extends lifespan in mice,eLife. 2012; 1: e00065. Published online 2012 Oct 15. doi: 10.7554/eLife.00065
[24] Starvation hormone markedly extends mouse life span, without need for calorie restriction. https://www.sciencedaily.com/releases/2012/10/121016103411.htm
[25] Bryn M. Owen,1 Angie L. Bookout,1,2 Xunshan Ding,3 Vicky Y. Lin,1 Stan D. Atkin,1 Laurent Gautron,2 Steven A. Kliewer,1,3,* and David J. Mangelsdorf1,4,FGF21 contributes to neuroendocrine control of female reproduction,Nat Med. 2013 Sep; 19(9): 1153–1156. Published online 2013 Aug 11. doi: 10.1038/nm.3250
[26] Comninos AN1, Jayasena CN, Dhillo WS. The relationship between gut and adipose hormones, and reproduction.,Hum Reprod Update. 2014 Mar-Apr;20(2):153-74. doi: 10.1093/humupd/dmt033. Epub 2013 Oct 30.
[27] WANG Xue-peng,HAO Yong-qiang, Ghrelin与骨质疏松相关性的研究进展,中华骨质疏松和骨矿盐疾病杂志,2010年12月第3卷第4期
[28] Life Extension News: Ghrelin: A Mere Hormonal Appetite Stimulant or a Possible Anti-Aging Molecule. http://www.life-enhancement.com/magazine/article/1980-ghrelin-a-mere-hormonal-appetite-stimulant-or-a-possible-anti-aging-molecule
[29] 6.Smith et al. Ghrelin receptor (GHS-R1A) agonists show potential as interventive agents during aging. Ann NY Acad Sci 1119:147-64 (2007).
[30] Kenyon CJ1. The genetics of ageing. Nature. 2010 Mar 25;464(7288):504-12. doi: 10.1038/nature08980.
[31] Yuan R1, Meng Q, Nautiyal J, Flurkey K, Tsaih SW, Krier R, Parker MG, Harrison DE, Paigen B.,Genetic coregulation of age of female sexual maturation and lifespan through circulating IGF1 among inbred mouse strains. Proc Natl Acad Sci U S A. 2012 May 22;109(21):8224-9. doi: 10.1073/pnas.1121113109. Epub 2012 May 7.
[32] Delayed female sexual maturity linked to longer lifespan in mice, ScienceDaily,https://www.sciencedaily.com/releases/2012/05/120507154103.htm
[33] http://baike.baidu.com/view/2040048.htm
[34] Jeong-Hoon Hahm, Sunhee Kim, Race DiLoreto, Cheng Shi, Seung-Jae V. Lee, Coleen T. Murphy & Hong Gil Nam,C. elegans maximum velocity correlates with healthspan and is maintained in worms with an insulin receptor mutation,Nature Communications 6, Article number: 8919 doi:10.1038/ncomms9919 Received 25 June 2015 Accepted 15 October 2015 Published 20 November 2015
[35] Oded Rechavi,Leah Houri-Ze’evi, Sarit Anava, Wee Siong Sho Goh, Sze Yen Kerk, Gregory J. Hannon, Oliver Hobert,Starvation-Induced Transgenerational Inheritance of Small RNAs in C. elegans,DOI: http://dx.doi.org/10.1016/j.cell.2014.06.020
[36] David Vilchez,Ianessa Morantte, Zheng Liu,Peter M. Douglas,Carsten Merkwirth,Ana P. C. Rodrigues,Gerard Manning & Andrew Dillin,RPN-6 determines C. elegans longevity under proteotoxic stress conditions Nature 489, 263–268 (13 September 2012) doi:10.1038/nature11315 Received 08 August 2011 Accepted 13 June 2012 Published online 26 August 2012
[37] sciencedaily,New protein involved in longevity identified. https://www.sciencedaily.com/releases/2010/05/100507161423.htm
[38] Palmitessa A1, Benovic JL.,Arrestin and the multi-PDZ domain-containing protein MPZ-1 interact with phosphatase and tensin homolog (PTEN) and regulate Caenorhabditis elegans longevity. J Biol Chem. 2010 May 14;285(20):15187-200. doi: 10.1074/jbc.M110.104612. Epub 2010 Mar 5.
[39] Baubec T1, Colombo DF1, Wirbelauer C1, Schmidt J1, Burger L2, Krebs AR1, Akalin A1, Schübeler D3.,Genomic profiling of DNA methyltransferases reveals a role for DNMT3B in genic methylation. Nature. 2015 Apr 9;520(7546):243-7. doi: 10.1038/nature14176. Epub 2015 Jan 21.
- 相关回复 上下关系8
🙂刚好看到卫报一篇文章,为什么人容易相信智能进化论 3 乔治·奥威尔 字6950 2016-04-07 22:56:59
🙂错字有点多了 桥上 字0 2016-04-08 01:12:45
🙂死亡起源(十三)—— 细胞的主动自杀(凋亡) 80 az09 字7087 2016-04-01 15:36:04
🙂死亡起源(十二)—— 寿命调节中的反馈机制
🙂真是生于忧患,死于安乐阿。 大拇指 字42 2016-04-10 12:13:56
🙂不知道古中国人从哪个外星人那听来的,顺者生育,逆者成仙 3 三力思 字205 2016-03-29 20:21:29
🙂张三丰《无根树》:顺为凡,逆为仙,只在中间颠倒颠。 9 迷惑不解 字407 2016-03-30 20:10:04
🙂实实在在的好文章 1 九拍 字86 2016-03-28 09:59:43